说明:本技术要求是指导陕西配方颗粒工艺研发和标准制定的技术规范。技术要求分三部分(1)基础研究 包括文献收集和样品采集, (2)技术研究 包括样品鉴定检测、工艺研究、质量标准研究, (3)资料撰写要求。
第一部分 基础研究
一、文献资料研究
1、本草文献研究综述资料,应注意历史文献的成书年代顺序。其格式可以参考谢宗万的《中药材品种论述》、楼之岑的《常用中药材品种整理和质量研究》。
2、近代全国不同产地的药材样品品质评价研究资料综述。注意收集不良反应信息、混伪品信息。
3、药材分布及《中国药典》2015版一部收载情况。
4、文献研究资料应简要准确,建议能使用表格的尽量使用表格描述。
二、样品采集
(一)药材采集
1、原药材应是国家或陕西省地方药材质量标准收载品种,而且是一名一物(一种一物)。
2、样品应至少保留名称、数量、采集方式、初步鉴定结果、产地(具体到县乡)、收集(采集)时间、种植方式(野生或家种)、干燥方法(烘干、阴干、晒干等)信息。
3、样品数量 样品批次应不少于15批(包括不同产地、不同采集时间等)。每批样品数量应保证实验用量和样品的留样,留样量一般为不少于300g。
4、样品保存 样品应按药品的特性进行保存,防止样品变质。一般应参考《中国药典》2015版的保存方法。
5、样品应有清晰明确的标识。
6、必要时可收集药材的原植物标本。
(二)辅料(含包材)采集
1、应有明确来源、质量标准、检验报告及选用依据。
2、有一定数量的生产单位/厂家。
3、本身质量稳定,符合药用要求。
第二部分 技术研究
三、原料药材的鉴定和检测
1、鉴定
应对原药材进行基原鉴定和确认;按照现行版《中国药典》并参考文献资料,由行业内有经验的人士对药材进行逐一鉴定,必要时可以采用行业专家公议的方式进行。
2、检测
按照药材的标准(以现行版《中国药典》一部或《陕西省药材标准》为首选),对原料药材进行全检,用于研究的原料药材必须符合标准规定。
3、根据浸出物和含量测定结果 分别画出质量曲线图并作出质量评价。
附图例,见图1 质量曲线图样例。
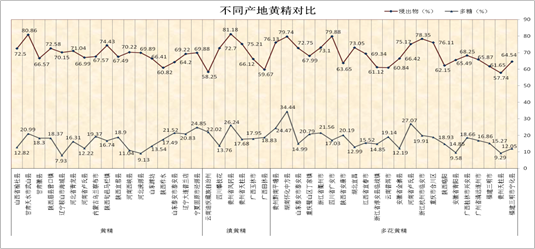
图1 质量曲线图样例
4、保留鉴定和检测记录。
四、工艺研究
根据临床用药需求,结合药物的具体情况及生产实际进行必要的研究,以明确具体工艺参数,做到工艺合理、可行,质量稳定、可控,以保证药品的安全、有效和质量稳定可控。
(一)炮制工艺研究
1、应按现行版《中国药典》一部或《陕西省中药饮片标准》的要求进行炮制。
2、制定炮制工艺操作规程。
3、结合中间体工艺控制和成品质量控制建立炮制品内控标准。
(二)标准汤剂工艺研究
标准汤剂系遵循中医药理论,按照临床汤剂煎煮方法规范化煎煮,固液分离,经适当浓缩制得或经适宜方法干燥制得,作为衡量中药配方颗粒是否与临床汤剂基本一致的标准参照物。标准汤剂系由不少于15批原料分别制得,计算相关均值,并规定其变异可接受的范围。中药配方颗粒的所有药学研究均须与标准汤剂进行对比,以保证与标准汤剂质量一致性。
标准汤剂的制备包括煎煮、固液分离、浓缩和干燥等步骤,应固定方法、设备、工艺参数和操作规程。
1、煎煮
在充分研究古今文献的基础上,考虑中药药性、药用部位、质地等因素,并参照卫生部、国家中医药管理局《医疗机构中药煎药室管理规范》国中医药发〔2009〕3号文,给出以下前处理方法、煎煮次数、加水量、煎煮时间等相关参数的参考值。煎煮用设备不做统一规定,但实验报告和申报资料中必须注明。建议每煎使用饮片量一般为100-200克,花、叶类等饮片可酌减。
(1)前处理:待煎饮片除应符合临床汤剂的规格外,还应视饮片质地按中药调剂“逢壳必捣,逢籽必破”等传统经验对饮片进行必要的处理。
(2)浸泡:待煎饮片应当先行浸泡,浸泡时间应根据饮片的质地确定,一般不少于30分钟。
(3)煎煮次数:每剂药一般煎煮两次。
(4)加水量:由于中药饮片的质地和吸水率相差较大,应根据不同的饮片确定加水量。加水量一般以浸过药面2-5厘米为宜,花、草类饮片或煎煮时间较长的饮片应当酌量加水。
第一煎:根及根茎类中药材一般加入饮片量9倍的水,果实种子类中药材一般加入饮片量8倍的水,茎干枝皮类中药材一般加入饮片量10倍的水,花叶全草类中药材一般加入饮片量12倍的水。
第二煎:根及根茎类中药材一般加入饮片量7倍的水,果实种子类中药材一般加入饮片量6倍的水,茎干枝皮类中药材一般加入饮片量8倍的水,花叶全草类中药材一般加入饮片量10倍的水。
(5)煎煮时间:煎煮时间应当根据药性及功能主治确定。一般煮沸后再煎煮30分钟;解表类、清热类、芳香类药物不宜久煎,煮沸后再煎煮20分钟为宜;滋补类药物先用武火煮沸后,改用文火慢煎约60分钟。第二煎时间可适当缩短。
(6)医疗机构中药煎药室管理规范-煎药操作方法节选
(水和浸泡时间) 第十二条 煎药应当使用符合国家卫生标准的饮用水。待煎药物应当先行浸泡, 浸泡时间一般不少于30 分钟。
(加水量) 煎煮开始时的用水量一般以浸过药面2-5cm为宜,花、草类药物或煎煮时间较长的应当酌量加水。
(煎煮次数) 第十三条 每剂药一般煎煮两次,将两煎药汁混合后再分装。
(煎煮时间)煎煮时间应当根据方剂的功能主治和药物的功效确定。一般药物煮沸后再煎煮20-30分钟;解表类、清热类、芳香类药物不宜久煎,煮沸后再煎煮15-2O分钟;滋补药物先用武火煮沸后,改用文火慢煎约40-60分钟。药剂第二煎的煎煮时间应当比第一煎的时间略缩短。煎药过程中要搅拌药料2-3次。搅拌药料的用具应当以陶瓷、不锈钢、铜等材料制作的棍棒为宜,搅拌完一药料后应当清洗再搅拌下一药料。
(药液量) 第十四条 煎药量应当根据儿童和成人分别确定。儿童每剂一般煎至100-300ml,成人每剂一般煎至400-600ml,一般每剂按两份等量分装,或遵医嘱。
(质量要求) 第十六条 药料应当充分煎透,做到无糊状块、无白心、无硬心。煎药时应当防止药液溢出、煎干或煮焦。煎干或煮焦者禁止药用。
第十七条 内服药与外用药应当使用不同的符合盛放食品要求的容器内,并应经过消毒处理,严防污染。
(煎煮温度) 第十九条 使用煎药机煎煮中药,煎药机的煎药功能应当符合本规范的相关要求。应当在常压状态煎煮药物,煎药温度一般不超过100℃。煎出的药液量应当与方剂的剂量相符,分装剂量应当均匀。
(包装) 第二十条 包装药液的材料应当符合药品包装材料国家标准。
2、固液分离
(1)分离:应趁热进行固液分离,滤材目数应在100目以上,要固定方法、设备、耗材和条件。
(2)冷却:滤液应迅速冷却,以抑制成分的热分解。
(3)混合:将两煎药液混合,备用。
3、浓缩和干燥
上述煎煮混合液,一般经浓缩制成规定量的浸膏或经适宜的干燥方法制成干燥品。
(1)浓缩:可采用减压浓缩方法进行低温浓缩,温度不超过50度。
(2)干燥:标准汤剂的干燥一般采用冷冻干燥方法制备为宜,可保证其质量的稳定和易于溶解及免加辅料。
4、关于标准汤剂的建议
(1)遵从但不拘泥《医疗机构中药煎药室管理规范》,同时参考《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》中标准汤剂的制备。
(2)结合中试工艺中因素设计应考虑到浸泡时间及吸水率、提取次数、提取时间、溶媒倍量、样品粒度、提取温度、浓缩、纯化、干燥工艺等因素。
5、相关参考文献
标准汤剂论
中药汤剂煎煮领域标准化的思考
中药汤剂的煎煮知识
中药饮片标准汤剂研究策略
中药饮片标准汤剂制备与质量标准研究方法概述
中药饮片标准汤剂的质量评价案例——金银花
白芍饮片标准汤剂质量标准研究
葛根饮片标准汤剂的研究
红花饮片标准汤剂的研究
栀子标准汤剂的质量评价方法考察
汤剂煎煮的规范化研究方法探讨
中药煎煮
(三)提取工艺研究
1、工艺设计
可根据预实验的结果,选择合理的工艺设计思路。
建议采用正交试验设计,也可采用均匀设计或响应曲面设计。应注意正交试验设计的基本方法,考虑因素之间的交互作用,试验设计的评价指标尽量选择多指标试验。关注正交试验设计的方差分析方法和重复试验与重复取样的正交试验的方差分析。
工艺中因素设计应考虑到浸泡时间及吸水率、提取次数、提取时间、溶媒倍量、样品粒度、提取温度、浓缩、纯化、干燥工艺等信息。
工艺设计应注意的主次顺序选择要合理、科学。
2、测定方法的选择
(1)首选《中国药典》2015版的方法,同时采用中间体工艺控制的方法来评价;
(2)建议:中间体工艺控制的方法含近红外或拉曼光谱法;
(3)首次采用的方法,建议进行方法学验证或确认。
3、工艺研究报告中应列出测定数据和结果。
4、保留检测结果的电子和纸质记录。
5、 相关参考文献
《试验设计方法》
《试验设计与数据处理》
《优化试验设计方法及数据分析》
(四)制剂成型性研究
1、制剂成型预试研究
根据配方颗粒相关规定,配方颗粒尽量保证与汤剂的一致性,使服用方便,增加服药顺应性,处方设计中尽量采用较少的辅料而达到最好的效果,辅料与中间体(以干燥品计)之比一般不超过1:1,不应添加矫味剂。
2、制剂成型性影响因素与考核指标的确定
制剂成型工艺应考虑成型及稳定性因素,并关注(但不限于)影响制剂质量的以下技术因素
(1)辅料种类及用量选择,
(2)粘合剂的选择,
(3)制粒方法选择,
(4)颗粒干燥工艺考察,
(5)颗粒流动性和抗压性考察,
(6)外观、粒度与溶化性,
(7)试验设备选择,
(8)剂量确定,
(9)包材的相容性试验和包装方法确定。
3、工艺验证
一般采用小试工艺10倍-50倍量进行3批中试工艺验证。工艺验证应关注:
(1)提取工艺参数的合理性,
(2)辅料种类用量的合理性,
(3)制粒方法、推荐设备的合理性,
(4)出膏率、成品率与小试数据的差异,
(5)工艺参数的可控性,
(6)中间体控制标准的适用性,
(7)成品质量。
4、工艺确认
(1)工艺研究的评价,
(2)确定后的工艺流程。
五、质量标准研究
(一)原药材内控质量标准
1、应对原药材进行基原鉴定和确认;
2、原药材应是国家或陕西省地方药材质量标准收载品种;
3、原药材应按国家或陕西省地方药材质量标准检验合格;
4、应依据国家或陕西省地方药材质量标准建立药材的内控质量标准,并编制内控质量标准起草说明。其正文格式除应有产地或采集地信息外,其余参照现行版《中国药典》。内控质量标准起草说明格式除应详细说明产地或采集地选择理由外,应对标准正文项目逐条逐项说明,并列出测定的数据;
5、内控质量标准应包含中药指纹图谱或特征图谱的内容(近红外或拉曼光谱法等光谱方法、或其他色谱方法)和中间体使用的质量控制方法。指纹图谱或特征图谱应与中间体、标准汤剂、成品相关联。
6、保留药材样本,每批不少于200g。
(二)饮片内控质量标准
1、饮片内控质量标准应在原药材内控质量标准的基础上制定;
2、饮片内控质量标准应突出性状鉴别方法,应关注炮制前后性状的变化和主要化学成分的变化,并依据试验结果给出质量评价指标和限度;
3、应建立饮片的制备工艺规程和内控质量标准,并编制工艺规程和内控质量标准起草说明;
4、保留饮片样本,每批不少于200g。
(三)标准汤剂的质量标准
1、标准汤剂的质量标准应在原药材、汤剂工艺路线确定的基础上制定;
2、标准汤剂的质量标准制定时应与药材、饮片做溶出(提取率)及主要化学成分变化的对比研究;
3、应建立标准汤剂的质量标准,并编制质量标准起草说明;
4、保留相关图谱的电子文本。
(四)中间体质量标准
1、结合提取、干燥、成型工艺路线,设计中间体的关键控制点,针对关键控制点建立质量控制方法;
2、中间体质量标准制定可参照中药配方颗粒的标准制定,应包含主成分的确认方法,(并建议使用近红外或拉曼光谱法。)主成分的确认方法(针对关键控制点)可以是理化鉴别方法、近红外或拉曼光谱法(指纹图谱)、含量测定方法(色谱法)等;
3、应建立中间体的对照指纹图谱或特征图谱(近红外或拉曼光谱法、色谱法)(的标准图谱),编制中间体质量标准起草说明;
4、保留相关图谱的电子文本。
(五)成品质量标准
1、结合成品并参照《中国药典》颗粒剂通则的要求,制定成品(制剂)质量标准;
2、成品质量标准的内容主要包括:名称、来源、制法、性状、鉴别、检查、浸出物、指纹图谱或特征图谱、含量测定、规格、贮藏。指纹图谱或特征图谱可以选择近红外法、拉曼光谱法、液相色谱法、气相色谱法等;
3、成品质量标准应与中间体质量标准、标准汤剂质量标准、饮片内控质量标准、原料药内控质量标准相关联;
4、应编制成品质量标准起草说明。其正文格式参照现行版《中国药典》起草说明格式应对标准正文项目逐条逐项说明,并列出测定的数据;
5、保留相关图谱的电子文本。
六、稳定性研究
1、结合成品的质量标准,进行稳定性考察。
2、按照现行版《中国药典》四部“原料药物与制剂稳定性试验指导原则”进行研究。应提供至少3个月的稳定性试验数据。
第三部分 资料撰写基本要求
七、资料撰写和提交
(一)资料的主要内容
1、综述
2、样品和辅料
3、炮制工艺研究
4、标准汤剂研究
5、提取工艺研究
6、成型工艺研究
7、制剂工艺
8、质量标准
9、参考文献
(二)文字要求
1、word格式,采用图文混排方式。版式大小A4,边界距离为默认;字体为宋体,大标题小二,小标题三号,正文小三。
2、提交纸质和电子文本资料。
3、为以后出版需求,同时提交图片的电子文件(原始图)。